PUBLICAÇÃO DO CONSELHO REGIONAL DE FARMÁCIA DO ESTADO DE SÃO PAULO
Nº 128 - NOV - DEZ/ 2016 - JAN/2017
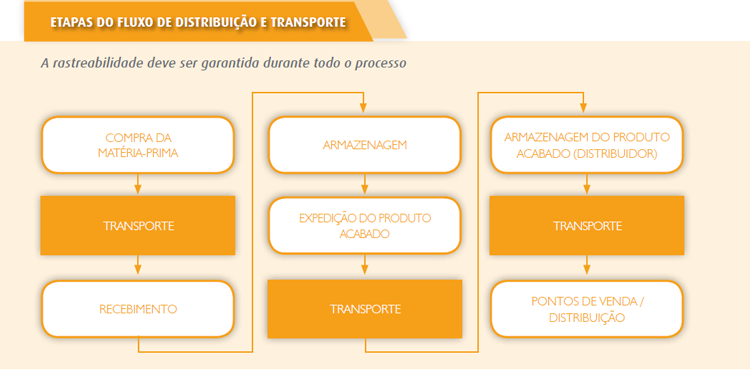
COMISSÕES ASSESSORAS / DISTRIBUIÇÃO E TRANSPORTE
GPS do medicamento
Publicada lei que implanta a rastreabilidade em medicamentos. Embalagens receberão identificação específica

Na década de 1990, o extravio e venda de lotes de pílulas fabricadas exclusivamente para teste de máquinas embaladoras e que continham farinha em vez de hormônios, resultou na gravidez de mulheres que tomavam o anticoncepcional em questão. Situação que poderia ter sido evitada se houvesse um monitoramento eficaz de todo o ciclo do medicamento desde a indústria ao consumidor final. É o que se espera com a recente lei 13.410, publicada em 28 de dezembro de 2016, que visa controlar a produção, a distribuição, a comercialização, a dispensação e a prescrição médica, odontológica e, caso contenha medicamento de uso humano, veterinária, assim como os demais tipos de movimentação previstos pelos controles sanitários.
A legislação altera a Lei 11.903/09, que instituiu o Sistema Nacional de Controle de Medicamentos, que visa garantir ao
consumidor a origem do medicamento, além de coibir o roubo e falsificação. Segundo relatório da Organização Mundial de Saúde (OMS), 19% dos medicamentos comercializados no Brasil são ilegais. A estimativa é que se vendam 20 medicamentos falsos em cada lote de 100. Eles são vendidos em feiras, bancas de ambulantes, pela internet e, inclusive, nas farmácias. E chegam ao Brasil vindos do Paraguai, China e Índia. Segundo pesquisadores da OMS, a pirataria de substâncias matou cerca de 700 mil pessoas no mundo em 2014.
De acordo com a lei, as embalagens de todos os medicamentos registrados receberão identificação específica baseada em sistema de captura, armazenamento e transmissão eletrônica de dados, contendo o número de registro do medicamento no órgão de vigilância sanitária federal competente, número de série único do medicamento, número do lote ou da partida do medicamento e data de validade.
Para Marcelo Oliveira Sá, executivo de negócios da GS1 Brasil - Associação Brasileira de Automação, um dos importantes benefícios da rastreabilidade é a visibilidade, ou seja, permite que a empresa ou até mesmo todos os parceiros envolvidos tenham a exata certeza do que aconteceu com determinado produto, por exemplo. “Isso é fascinante, pois abre a oportunidade para que se faça uma gestão melhor de produtos em caso de risco iminente ou presenciado, aprimora muito o processo de recall, atribui organização, disciplina e método aos processos operacionais gerando maior eficiência e, por fim, paralelamente, transmite-se para os envolvidos, principalmente aos consumidores, o compromisso assumido de oferecer produtos e serviços cada vez melhores”.
O Sistema Nacional de Controle de Medicamentos deverá contar com banco de dados centralizado em instituição do governo federal, para armazenamento e consulta das movimentações dos medicamentos sob sua responsabilidade. De acordo com a lei 13.410/16:
- Cada membro da cadeia de movimentação de medicamentos é responsável por transmitir ao referido banco de dados todos os registros a respeito da circulação dos medicamentos sob sua custódia.
- As informações deverão estar consolidadas em banco de dados que permita a consulta pelo órgão de vigilância sanitária federal competente, quando solicitado.
- Comete infração sanitária o estabelecimento que deixar de comunicar qualquer informação a respeito da movimentação de medicamento.
- O membro da cadeia de movimentação de medicamentos terá acesso, para consulta, apenas aos dados por ele inseridos no sistema e àqueles estritamente necessários à adição de novas informações sobre a movimentação dos medicamentos sob sua custódia.
- As informações constantes do banco de dados previsto no caput devem ser tratadas como informações confidenciais, não podendo ser divulgadas ou comercializadas.
Prazo para implementação
Após a conclusão da regulamentação por parte da Anvisa, que, de acordo com a lei deve ser em até quatro meses, as demais etapas de implantação do Sistema Nacional de Controle de Medicamentos obedecerão aos seguintes prazos:
I - até um ano, para que a indústria, os importadores e os representantes da distribuição e do varejo escolhidos pelo órgão de vigilância sanitária federal competente possam, em caráter experimental, receber e transmitir dados referentes a, no mínimo, três lotes de medicamentos que contenham as informações previstas nos incisos I, II, III e IV do parágrafo 1º do artigo 3º.
II - até oito meses após o término da etapa anteriormente citada para que os resultados obtidos durante a fase experimental sejam objeto de análise, correção e relatório de validação pelo órgão de vigilância sanitária federal competente, por meio do Comitê Gestor.
III - até três anos após o término da etapa citada no item acima, para a completa implementação do Sistema Nacional de Controle de Medicamentos.
Por Thais Noronha